2025年10月30日,乐普生物MRG003(维贝柯妥塔单抗)获得NMPA批准上市,用于治疗既往经至少二线系统化疗和PD-1/PD-L1抑制剂治疗失败的复发/转移性鼻咽癌患者,商品名为美佑恒。
MRG003为全球首款获批上市的EGFR ADC新药,标志着国产ADC又一个全新里程碑。MRG003在分子设计上进行了充分的差异化设计,采用高亲和力(比西妥昔单抗高6-7倍)、快速内吞的EGFR抗体,通过vc可裂解linker偶联MMAE毒素,DAR值为4。
今年ASCO会议上,MRG003治疗晚期鼻咽癌注册性随机对照临床研究数据以late-breaking abstracts(重要突破摘要)的形式首次公开,入组标准为既往经过至少两线治疗包括化疗及PD-(L)1抗体治疗,入组173例晚期鼻咽癌患者,86例接受MRG003治疗,87例接受化疗治疗。两组患者既往接受治疗线数的中位数均为三线,其中接受过三线及以上治疗的患者比例达到73.4%。

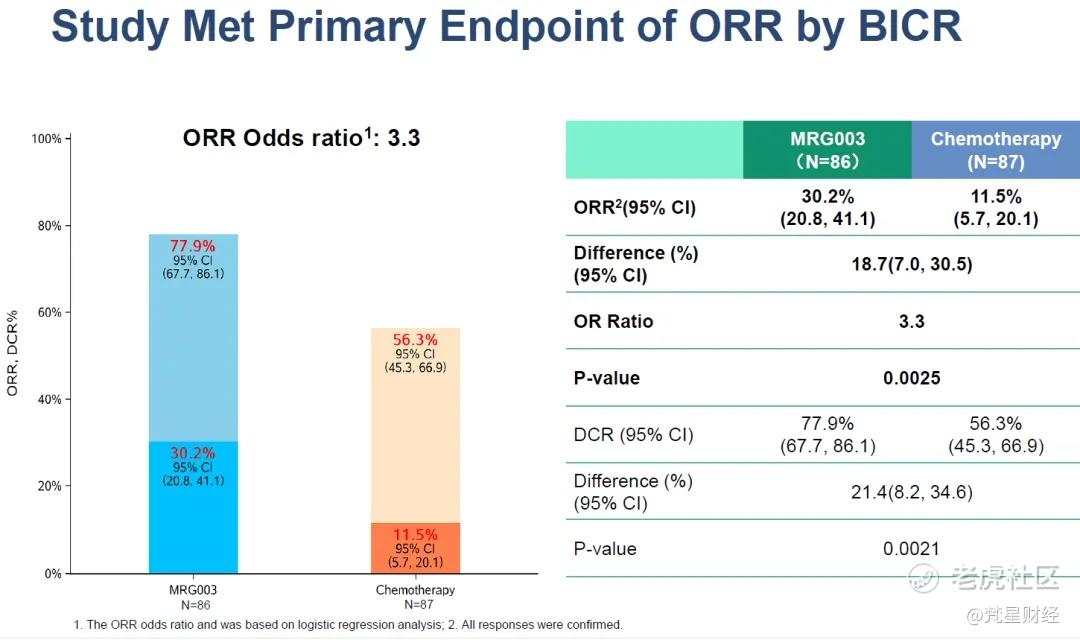
该关键注册性临床达到ORR主要终点,MRG003治疗组和化疗对照组的ORR分别为30.2%、11.5%,ORR提高至近3倍,p值为0.0025。DCR分别为77.9%、56.3%,意味着疾病进展的患者比例减少一半。对于主要终点PFS,MRG003治疗组和化疗对照组的mPFS分别为5.82个月、2.83个月,实现翻倍,疾病进展或死亡风险降低37%。OS数据尚未成熟,初步结果显示MRG003的中位OS为17.08个月,化疗对照组为11.99个月,HR为0.73,提示患者能够在MRG003治疗后实现长期生存获益。
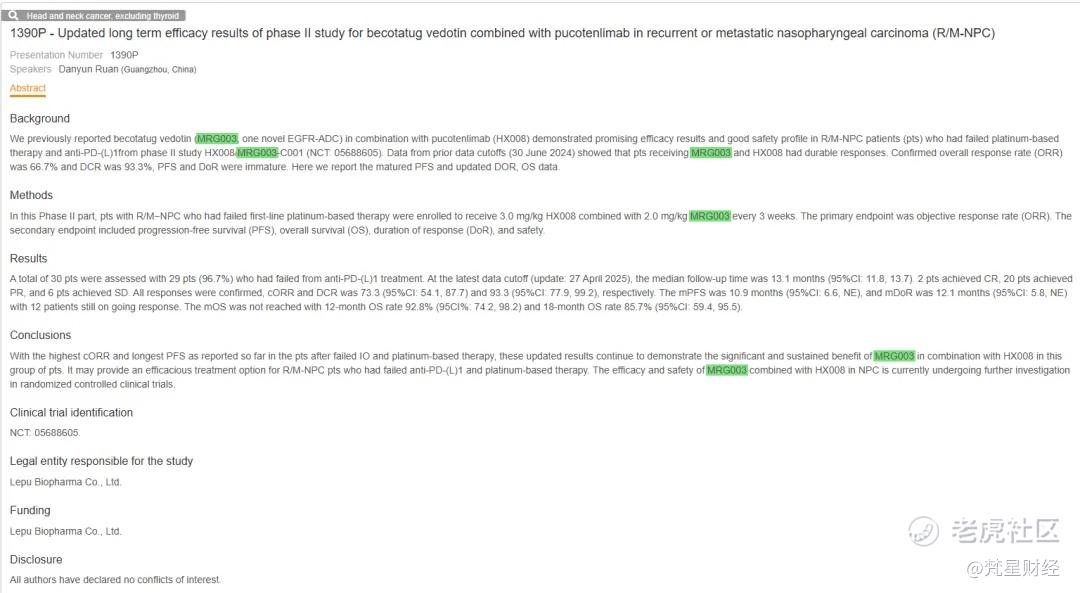
本月召开的ESMO大会上,乐普生物汇报了MRG003+普特利单抗联合治疗晚期鼻咽癌的二期临床最新数据,该二期临床共入组30例患者,入组标准为铂类化疗及PD-1治疗后进展的患者,中位随访时间13.1个月,2例患者达到CR,20例患者达到PR,6例患者SD,cORR为73.3%,DCR为93.3%,mPFS为10.9个月,mDOR为12.1个月,mOS尚未达到,12个月OS率为92.8%,18个月OS率为85.7%。MRG003+普特利单抗联合治疗获得了历史最佳的ORR和mPFS数据,IO+ADC联合治疗进一步提升疗效。此外,30例患者中29例经过PD-1治疗后进展,9例经过EGFR单抗治疗后进展,意味着MRG003+普特利单抗可以突破耐药。
总结
乐普生物在IO+ADC领域进行了系统布局,并不断取得突破性临床进展。MRG003率先在鼻咽癌取得突破,成为全球首款获批上市的EGFR ADC新药,标志着IO之后ADC也进入商业化阶段。在国际化方面,乐普生物MRG007为首款完成授权出海合作的CDH17 ADC,在胃肠道肿瘤领域的布局也进入加速发展阶段。本月ESMO会议上,乐普生物PD-1+EGFR ADC在头颈癌、鼻咽癌的二期临床均获得优异数据,IO+ADC进一步巩固和扩展其临床地位。

来源:Armstrong生物药资讯
精彩评论