原文:慧医养
肝细胞癌(HCC)是常见的肿瘤类型,死亡率居前列。尽管治疗策略有所进展,但患者的缓解率和总生存率仍然较低。#肝细胞癌 的主要病因包括乙肝、丙肝感染、酗酒、糖尿病和非酒精性脂肪肝等引起的肝硬化。许多肝细胞癌患者在晚期被诊断出,他们的长期生存率仍然很差,5 年生存率低于 20%。
目前,肝癌最有效的治疗方法是肝切除术或肝移植。然而,手术切除后的复发仍是一个主要问题,肝癌的治疗方案有限,总体疗效不佳。索拉非尼和瑞戈非尼是目前针对无法切除的肝癌患者最有效的药物。美国食品药品监督管理局批准的药物,如纳武利尤单抗、瑞戈非尼、雷莫西尤单抗、卡博替尼和乐伐替尼,以及靶向化疗和免疫检查点抑制剂的联合疗法已可应用。但由于索拉非尼或瑞戈非尼对肝癌患者疗效有限,且患者 3 个月生存率较低,手术切除或肝移植仍是早期肝癌的首选根治性治疗方法。
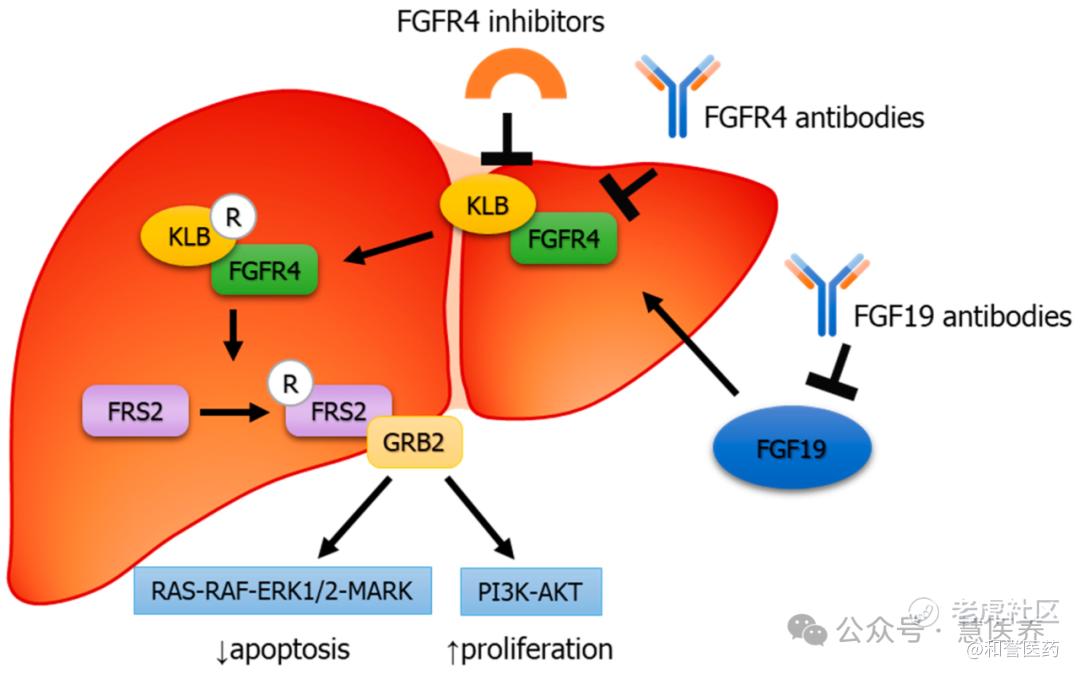
#FGFR4 的异常表达与癌症的多个特征相关,如促进肿瘤生长和转移。特定的 FGFR4 基因突变会增加患癌风险,它还参与多种肿瘤类型的发生发展。FGFR4 的激活机制是通过与配体结合并在共受体 klotho-beta(KLB)的参与下激活,激活后调节多个信号通路,如 GSK3β/β-catenin、PI3K/AKT 等,影响细胞的增殖、分化等过程。
#FGF19 是内源性成纤维细胞生长因子,与 FGFR4 结合亲和力最高,基因位于 11q13。其主要作用于胆汁酸合成等生理过程,也参与癌症的多个特征,在肝脏相关功能调节中发挥重要作用,约30%的肝细胞癌(HCC)存在成纤维细胞生长因子19(FGF19)过表达(+)的情况。当 FGF19 与 FGFR4 结合形成复合物,激活 Ras–Raf–ERK1/2 MAPK 和 PI3K–Akt 通路,促进肿瘤细胞增殖和抗凋亡,该复合物的异常表达与肝细胞癌进展密切相关。因而在机制上通过抑制 FGFR4 的活性阻滞相关信号传导,可达到抑制肿瘤生长的目的。FGF19–FGFR4 信号通路的异常表达促进肝细胞癌进展,是潜在的治疗靶点。
依帕戈替尼 (Irpagratinib,代号:ABSK011) 是由上海和誉生物医药科技有限公司研发的的高选择性成纤维细胞生长因子受体4 (FGFR4) 小分子抑制剂用于治疗 FGF19 过表达的#晚期肝细胞癌(aHCC)。目前全球尚无 FGFR4 抑制剂获批上市,依帕戈替尼有望成为首个治疗 FGF19 过表达晚期肝细胞癌患者的突破性药物。
2024 年和誉生物公布了依帕戈替尼联合抗阿替利珠单抗(PD - L1 抗体)治疗晚期肝细胞癌患者的最新临床试验研究结果,相关临床结果刊登在 ESMO 肿瘤学年鉴《ANNALS OF ONCOLOGY》。

截至2024年3月18日,36 名患者接受了 ABSK - 011 给药,其中每日一次180毫克组(N = 6)、每日一次320毫克组(N = 6)、每日两次160毫克组(N = 8)和每日两次220毫克组(N = 16)。在 28 例可评估疗效的患者中,每日一次320毫克组有2例缓解者(其中1例FGF19过表达),每日两次220毫克组有 5 例缓解者(均为FGF19过表达)。每日两次 220 毫克的给药方案显示出令人鼓舞的疗效,在 FGF19 过表达的肝细胞癌患者中总缓解率达 55.6%(5/9)。所有剂量组中最长的缓解持续时间 (DOR) 为 15.4 个月,中位DOR尚未成熟。根据实体瘤疗效评价标准1.1版(RECIST v1.1),研究者评估发现有 7 例部分缓解。
在这36名患者中,仅1名患者(每日两次160毫克组)出现剂量限制性毒性(DLT):丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)升高,同时血胆红素和碱性磷酸酶也升高。安全性结果显示,30名患者(83.3%)出现了与ABSK - 011或阿替利珠单抗相关的治疗不良反应(TRAEs)。≥2名患者报告的3级TRAEs包括ALT升高(6/36,16.7%)和AST升高(3/36,8.3%),其中大多数为短暂性的,在中断给药和/或支持性治疗后有所改善,未出现4/5级TRAEs。4名患者(11.1%)报告了严重的TRAEs,包括ALT升高(3例)/AST升高(2例)/血胆红素升高(2例)和便血(1例)。ABSK - 011联合阿替利珠单抗显示出令人鼓舞的抗肿瘤活性和可控的安全性,这支持在 FGF19 过表达的肝细胞癌中进一步开发该方案,并探索基于ABSK - 011的双联/三联组合用于更早期的治疗。
2024 年 12 月 16 日,和誉医药宣布,依帕戈替尼获中国国家药品监督管理局药品审评中心(CDE)批准,开展治疗肝细胞癌(HCC)的注册性临床研究。该研究(ABSK - 011 - 205)为多中心、随机、双盲试验,旨在评估依帕戈替尼联合最佳支持性治疗(BSC)与安慰剂联合 BSC,在经免疫检查点抑制剂 (ICI) 和多靶点酪氨酸激酶抑制剂 (mTKI) 治疗且 FGF19 过表达的晚期或不可切除肝细胞癌患者中的有效性和安全性,这是支持依帕戈替尼上市的关键依据,当前该研究正在开展中。
精彩评论