2025年,是BTK抑制剂在自免疾病领域突破的元年。前有赛诺菲的Wayrilz获得FDA批准原发免疫性血小板减少症(ITP)成为全球首个获批的自免BTK抑制剂,后有诺华的Rimeximod获批用于接受H1抗组胺药治疗后仍有症状的CSU患者。
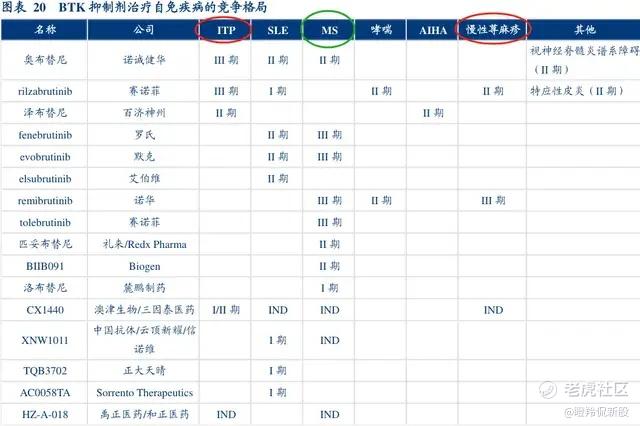
在自免BTK抑制剂的开发竞争中,临床开的最密集的无疑是ITP、系统性红斑狼疮(SLE)和多发性硬化症(MS),如今ITP已经率先成药,SLE普遍处于早期临床,而MS则是处于接连失败的阴云之下(默克、赛诺菲均有分子临床折戟)。
(图源:华创医药)
随着罗氏Fenebrutinib(以下统称:Fene)在MS三期率先拿下阳性结果,BTK抑制剂在自免领域的前景,愈发明朗。
11月10日,罗氏宣布Fene针对复发性多发性硬化症(RMS)患者的两项关键、设计相似的III期研究(FENhance 1和FENhance2)中的FENhance 2研究达到了主要终点:在至少96周的治疗期内,相比特立氟胺,Fene年复发率(ARR)显著降低。
另外,评估Fene与奥瑞利珠单抗在原发性进展性多发性硬化症(PPMS)患者中疗效的III期关键研究FENtrepid也达到了主要终点,在至少120周的治疗期内,Fene非劣于奥瑞利珠单抗(PPMS目前唯一获批疗法)的疗效。
罗氏计划在2026H1等待针对RMS的FENhance 1研究的临床结果公布再进一步提交Fene的上市申请。
尽管Fene在MS领域的积极前景尚还有不确定性,但投资者们还是不能忽视这个难成药适应症带来的一些潜在的机会。
01 多发性硬化:食之无味弃之可惜的大适应症
MS是一种复杂的中枢神经系统慢性炎性脱髓鞘疾病,源于包裹神经元轴突的髓鞘退化,当髓鞘鞘受损时,神经元信号传导受阻,导致运动和感觉功能紊乱,症状随着时间进展,该病初期典型症状包括视力下降、肢体无力等,疾病后期患者可能会失去对肌肉的控制、出现失禁、下肢瘫痪或出现精神功能障碍。
MS多发于20-40岁青壮年,也是导致年轻人非创伤性残疾的最常见原因,全球受影响人数多达290万,美国至少有50万人患病,更有MS专家认为这一数字实际接近100万。
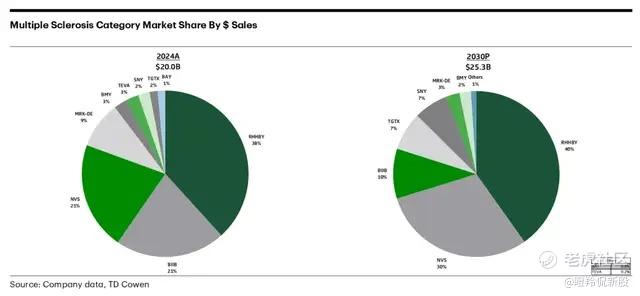
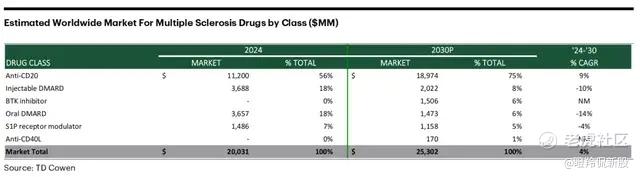
有数据显示,2024年MS存量治疗市场仍达到200亿美元(同比增长6%),预计到2030年这一市场规模将达到253亿美元(CARG为4%)。由于MS患者症状明显影响生存质量,普遍治疗意愿和就诊率极高,美国患者年治疗费用约10万美元,中国患者医保后年治疗费用约7-8万人民币。
MS患者大致可分为4大类疾病分型,60 - 65%的患者患有复发缓解型多发性硬化症(RRMS),30%患有继发进展型多发性硬化症(SPMS,还分活动性和非活动性),5%患有原发进展型多发性硬化症(PPMS),不到5%患有进展复发型多发性硬化症(PRMS/BMS)。
既然市场支付能力那么强、渗透率也能做高,为什么说MS是一个“鸡肋”的适应症?
一个是临床终点的采纳和判定,早期概念验证研究一般使用MRI病灶数量(如大脑和脊髓中新发或扩大的病灶数量)或年复发率(ARR)作为主要终点,因为这些结果出现更快,所需样本量更小;而MS临床真正的金标准是扩展残疾状态量表(EDSS)评分(CDP,即确认的残疾进展),这是评估神经功能残疾程度变化的核心指标,其主要基于患者的活动能力、行走距离等客观神经功能检查,FDA、EMA要求残疾进展必须持续一段时间(如3或6个月)才能进行“确认”。
所以,如果是药企需要做一个CDP主要终点的MS相关适应症研究,往往所需样本量大(上千人是常态),并且随访时间最长(通常24-30个月),这并非一般的Biotech能够承担,大药企在这方面优势更强。另外,MS药物开发的失败率非常高,对于Biotech而言性价比确实不佳。
如下图所示,全球MS市场前三名分别为罗氏、渤健和诺华,前9位只出现了TG Therapeutics这一家Biotech。
从治疗满足度来看,现有CD20单抗、S1P调节剂可覆盖RMS和活动性SPMS,而PPMS仅奥瑞利珠单抗一款药物获批,PPMS、非活动性SPMS均缺乏有效治疗手段。
看下来,MS领域的未满足临床需求还是很大的。相比现有的CD20单抗、抗风湿修饰药物等竞品,BTK抑制也有自身独特的优势和差异化,不仅提供了一种全新的口服治疗方式,并且其能够穿透血脑屏障,对SPMS也能产生治疗效果,扩大治疗应用。
02 罗氏Fene重燃MS市场
罗氏Fene是一款可逆、非共价的BTK抑制剂,研究表明其对BTK的选择性比对其他激酶高130倍,具备对BTK高选择性和不易误伤其他激酶的高安全耐受性,其次其具备良好的血脑屏障穿透能力,除了抑制B细胞活性(抗炎)外还能在CNS中抑制小胶质细胞。
正如前文所述,罗氏的Fene在MS领域开展了三项注册性研究,一个是RMS的两项设计高度相似的FENhance 1和FENhance2,另一个是在PPMS的FENtrepid研究。
从设计上来看,FENhance 1(736例患者)和FENhance2(751例患者)两项研究都采取了一致的主要终点,包括年化复发率(ARR)、至12周确认的残疾进展时间(cCDP12);试验组和对照组设计层面,试验组接受200mg Fene每日口服两次治疗,而对照组接受每日口服一次14mg特立氟胺片剂治疗。
分析临床设计,Fene的阳性对照物特立氟胺确实是国际和国内指南公认的一线标准治疗药物之一(不少新药物由于特立氟胺疗效太好而临床折戟),在此背景下达成了明显ARR的降低难得(另一个终点cCDP12和临床统计意义情况似乎未提及)。另外,罗氏的申报上市策略可能基于两项三期的完整数据,由于FENhance 1研究尚未公布,也留下了一些悬念和市场对数据的猜疑。
另一项PPMS的FENtrepid研究,试验共纳入985例患者,试验组接受每日口服两次200mg Fene治疗,对照组静脉输注600 mg奥瑞珠单抗(Ocrevus),主要终点为至12周确认的残疾进展时间(cCDP12),该复合终点同时纳入EDSS评分变化、25英尺步行计时、9孔插钉测试等指标。
值得注意的是,这是一项非劣效结果,Fene在至少120周的治疗期内在延缓综合确认残疾进展的发生不劣于Ocrevus。
目前,市场仍存有疑惑的点可能在于,FDA是否认可Fene仅凭Ocrevus非劣性结果进行NDA申报,且FDA对于EDSS评分变化复合终点的权重如何(需等待进一步数据披露)。
不过,罗氏Fene能够在RMS和PPMS这两大适应症同时获得阳性数据已经是BTK抑制剂在MS的巨大突破。要知道进度最快的赛诺菲Tolebrutinib在RMS三期也并未取得ARR阳性结果,而是在对照安慰剂的非活跃性SPMS三期取胜。
Fene的成功,为后来的新一代BTK抑制剂在MS领域开发提供了巨大的曙光。
03 Zenas/诺诚健华的机会
中国Biotech开发自免BTK抑制剂并且在MS领域临床进度靠前的,非诺诚健华莫属。
从设计特点来看,诺诚健华的奥布替尼与罗氏的Fene有非常多相似的特点,奥布替尼虽然是一款不可逆、共价的BTK抑制剂,但其拥有对BTK高选择性(例如对BTK靶点的占有率近100%),并且拥有一定的透过血脑屏障能力,这大概率是开发MS适应症的必备“技能”(安全性和抑制脑内小胶质细胞)。
再从诺诚健华奥布替尼的合作方Zenas BioPharma审视,该公司在自免疾病甚至细分到MS适应症有自身独特的见解和能力。
一是在引进奥布替尼之前,公司已有一款CD19/FcRIIb双抗Obexelimab正在探索在MS适应症的疗效;而在10月底Obexelimab治疗RMS的二期临床取得阳性结果,与安慰剂相比,接受Obexelimab治疗患者新的钆增强T1病灶减少了95%,且在治疗8周时,这些炎症标志物几乎完全被抑制,并持续到第12周。
至少从Zenas已有MS相关产品并取得初步成药信号的角度来看,这家公司的临床能力和在MS领域的经验是充足的。
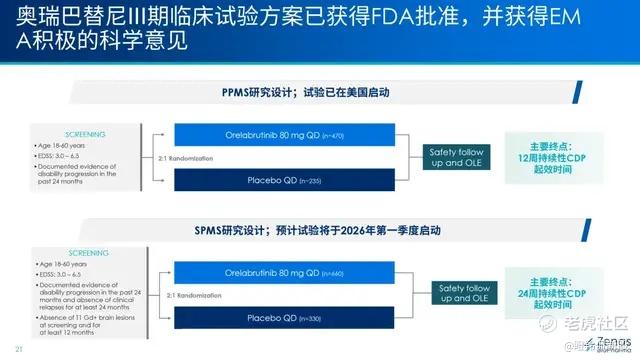
二是奥布替尼未来在美国开展2项三期注册性临床,其中PPMS适应症三期已经在美国启动,而SPMS的海外三期将在2026Q1启动,两个临床预计分别入组人数在700多人和900多人。
值得注意的是,奥布替尼没有选择RMS这样市场更大的适应症,而是选择目前没有获批药物或者获批药物较少的PPMS和SPMS,显然有独特的思考和做出阳性结果后有相对较易的审批路径。
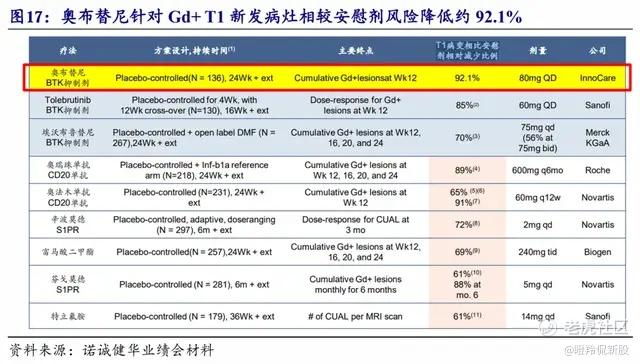
另外在Zenas合作伙伴的加持下,奥布替尼过往披露在RRMS的二期临床数据显得更为亮眼,在80mg治疗组针对Gd+T1新发病灶(活动性炎症的金标准,可提示新发病灶或复发期活动)相较安慰剂风险降低约92.1%,优于大多数竞品数据。
基于MS产品迭代较慢,奥布替尼的潜力是可以被充分看见的。
审视Zenas/诺诚健华奥布替尼的不确定性,未来更关注的或许应该是三期临床设计对照安慰剂的临床是否能够获得FDA审批认可。而投资者同样需要考虑的是,前述提到CDP研究至少需要持续24-30个月,叠加大量患者的入组时间,推算奥布替尼海外的临床结果至少要在2028-2029年了,两者在MS的催化空窗期较长。
结语:访谈部分国内Biotech,MS确实是一个“老大难”的冷门适应症,难题包括投入大、临床时间久、国内市场有限等,但正是这样正彰显出罗氏Fene三期突破的难能可贵和诺诚健华奥布替尼的出海价值,基于BTK抑制剂ARR能够媲美CD20降低至0.15以下和MS注册性三期的突破,自免BTK抑制的巨大市场正在被引爆。 $诺诚健华(09969)$ $诺诚健华(688428)$ $Zenas BioPharma Inc.(ZBIO)$

精彩评论