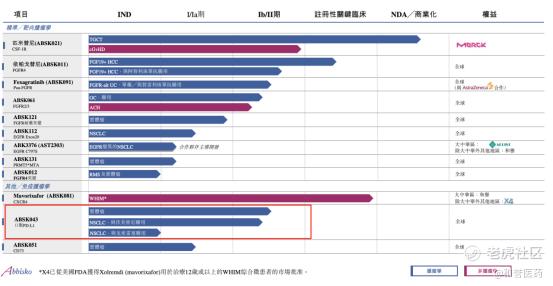
医药跟踪——和誉口服PD-L1抑制剂ABSK043单药治疗晚期血管肉瘤临床研究,完成首例患者入组
上次扒了和誉的ABSK011,发现了新的意外收获:《医药跟踪——三联疗法冲击肝癌一线,和誉医药ABSK011启动最新临床》。然后秉着继续寻宝的目的,把和誉的其他管线都扒了一遍,发现还有一个新的惊喜:
$和誉-B(02256)$ 的口服小分子PD-L1抑制剂ABSK043在血管生成性肉瘤患者中的II期试验开始启动了。根据clinicaltrials.gov,9月9日名为SARC-005的研究,进行了动态更新,猜测应该是首位患者已经入组。
这项研究,我觉得非常有意思。
1、额外的期待
这项研究对于ABSK043可以说是额外的期待。
因为SARC-005并非是和誉直接作为申办者发起,而是来自加拿大大学医疗网络(University Health Network)的一项由研究者发起的临床研究。该研究探索的领域既不是PD-1(L1)的常见适应症比如肺癌、胃癌等,也不是时下流行的联合治疗,而是单药治疗内膜肉瘤、头颈部血管肉瘤及上皮样血管内皮瘤等罕见血管肉瘤亚型。
对于这类患者来说,目前除了传统的化疗之外没有什么有效的治疗手段。即便是化疗,对于某些亚型的客观缓解率ORR依然不足10%,无进展生存期PFS短的也仅有3个月,明显无法满足临床需求。
尽管这类疾病高度异质,既往研究结果数据有限且难以解读,但有初步证据提示上述亚型的肉瘤患者可能对免疫单药治疗敏感。根据网站登记的信息,加拿大大学医疗网络的SARC-005研究,预计入组20名患者,最快明年3月份就能基本完成并获得初步结果。
对于ABSK043这款当下全球领先的口服小分子PD-L1抑制剂来说,SARC-005研究毫无疑问将开启一扇新世界的大门。和誉官网显示ABSK043目前正在开展两项在肺癌中联合靶向治疗的II期临床研究,都针对有着巨大市场前景的目标人群。罗氏制药的阿替利珠单抗凭借49例病人的数据,被FDA批准单药用于治疗腺泡状软组织肉瘤(alveolar soft part sarcoma,ASPS)。一旦SARC-005取得显著疗效,不仅意味着ABSK043多了一条在全球范围内快速注册上市的路径,更意味着口服PD-L1抑制剂也可以同抗体在单药适应症中一较高下,这样不论单药治疗还是联合治疗,都能成为更安全便捷的口服免疫检查点抑制剂抢占抗体已有市场的重要赛道。
2、更深层次的意义:ABSK043得到国际认可
不过,这项研究的启动,我认为还是另一深层次的意义:ABSK043得到国际认可,研发硬实力被进一步佐证。
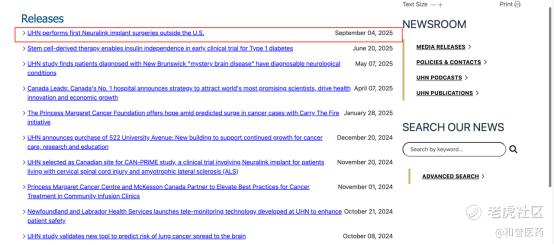
加拿大大学医疗网络来头不小,是加拿大排名第一的医院,国际影响力突出,连续四年位列世界五大医院之一,拥有众多世界首创的创新成果。例如,当下全球脑机接口的顶流– Neuralink,在美国以外进行的首例手术,就是在加拿大大学医疗网络开展的。目前已经获批的PD-1、PD-L1抗体不在少数,而ABSK043却获得了顶级医疗机构的青睐并开展相关临床研究,可见其差异化优势足够显著,引得一流专家跃跃欲试。
我妄自猜测,应该有2个核心原因。
第一,从机制上看,口服PD-L1使用方便、能够改善患者依从性。更重要的是,口服制剂的药代动力学特性是它具有更好地安全性,特别是用药剂量方便调整,可以更灵活有效地控制免疫相关副作用。
第二,和誉公布的一系列数临床据验证了上述特点。在公布的I期研究中,ABSK043在肺癌患者中疗效显著、安全可控、耐受良好。很难说不是这份成绩单“说服”了加拿大大学医疗网络。
最近创新药二级市场如火如荼,在一众企业纷纷高举高打恨不得要披露还没立项的管线以追逐市场热点时,像和誉这种不声不响悄悄布局的公司反而成了一股清流。然而低调也还是掩盖不了野心,小编我这两次扒到的信息都明确指向了和誉对把现有管线充分推向更广阔适应症的决心。至于是单纯的业绩预告更有看头,还是实打实获得国际认可的项目进展更有份量,就交给时间来回答吧。请各位再次期待小编的下一次意外惊喜~
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。