ESMO会上披露三核心管线数据,乐普生物中期成长确定性再增强
2025年欧洲医学肿瘤学会(ESMO)于本月中旬在德国柏林开幕。10月13日,乐普生物三项核心管线(MRG004A治疗晚期胰腺癌、MRG003联合普特利单抗治疗一线复发/转移性头颈鳞癌、MRG003联合普特利单抗治疗复发/转移性鼻咽癌)最新临床数据摘要已在ESMO公布,多项数据数据呈现积极结果,充分展现公司核心管线的研发价值。
现我整合 $乐普生物-B(02157)$ 披露的信息,对比几个癌种既往治疗方案,将乐普生物三项核心管线研究数据给大家做一下深度分析。
01 MRG004A治疗晚期胰腺癌
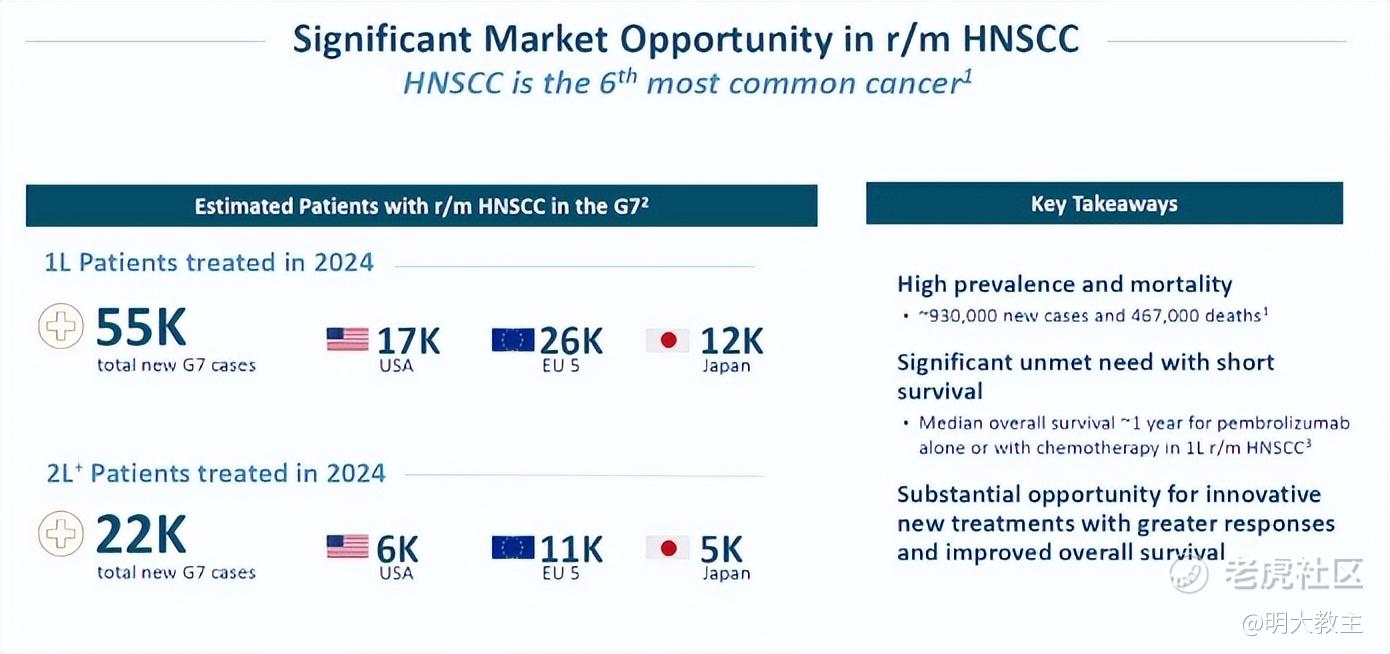
胰腺癌手术局限性大,免疫治疗的效果也十分有限。胰腺癌5年生存率仅有12%,中位生存时间仅10-12个月,因此胰腺癌素有“癌王”称号。
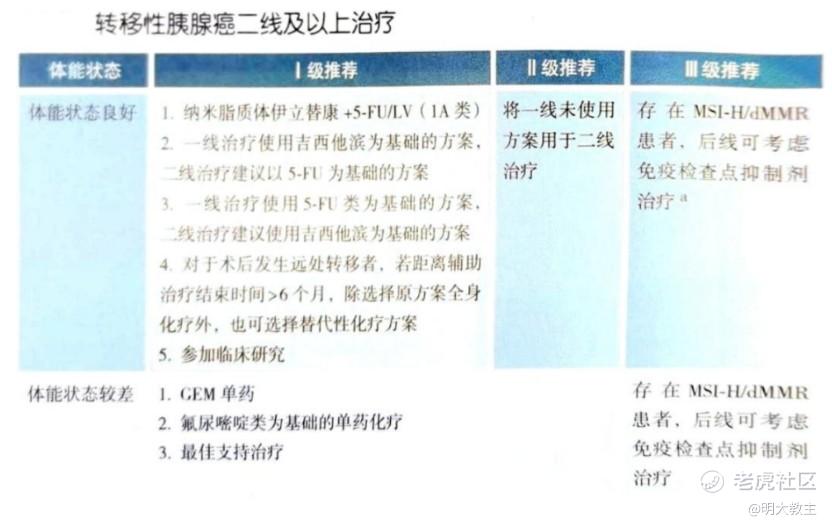
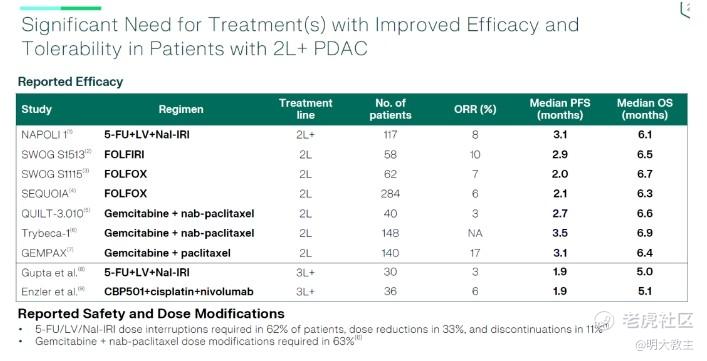
伊立替康脂质体联合5-氟尿嘧啶/亚叶酸钙方案作为胰腺癌二线治疗的I级推荐方案,中位PFS为3.1个月,中位OS为6.1个月。目前胰腺癌三线治疗无标准治疗,历史数据报道胰腺癌三线治疗方案ORR极低,mOS约6个月。
(2024年《CSCO胰腺癌诊疗指南》)
伊立替康脂质体联合5-氟尿嘧啶/亚叶酸钙治疗二线胰腺癌患者mOS 6.1个月,mPFS 3.1个月。2024年《CSCO胰腺癌诊疗指南》将伊立替康脂质体联合5-氟尿嘧啶/亚叶酸钙方案作为胰腺癌一线治疗失败后二线治疗的I级推荐方案。
2024年ASCO上公布的乐普生物MRG004A治疗胰腺癌患者初步数据显示,在既往接受过中位3线治疗的患者中,MRG004A的ORR 33.3%,DCR 83.3%。其中,在5例TF高表达(TF≥50%)且治疗线数2线以内的亚组中,4例PR,DCR 100%。接受MRG004A治疗的患者只有7.9%曾出现严重不良事件,3-4级治疗相关不良反应的发生率25%。MRG004A有效性、安全性初步显现。
在今年ESMO大会上,乐普生物披露的MRG004A I期临床数据显示:39例胰腺癌患者接受了2mg/kg MGR004A治疗(其中20例既往接受过二线治疗,9例既往接受过三线治疗)。中位随访时间15.5个月时,在37例可评估患者中,10例既往接受一线治疗的患者ORR 40%,DCR 80%,mPFS、mOS分别为5.8个月和13.2个月。
现即使未经头对头试验验证,但MRG004A治疗后线胰腺癌患者的mPFS、mOS有效性数据几乎均是《CSCO胰腺癌诊疗指南》I级推荐的伊立替康脂质体联合化疗方案的2倍。考虑到胰腺癌中位生存时间仅1年,乐普生物MRG004A这份超15个月的随访数据相当有说服力。如此炸裂的疗效数据不仅有较高的BIC潜力,甚至有望弥补晚期胰腺癌标准治疗的空白。
安全性方面,接受过MRG004A治疗的患者中有15名发生了3级(及以上)不良反应,无与药物相关的死亡事件出现。药物相关不良反应多为结膜炎、AST升高、ALT升高,且大多数不良反应经药物对症治疗后可恢复。
MRG004A不依赖特定基因突变,患者无需接受特定基因检测,毕竟组织因子(TF)在胰腺癌表达量较高,约95%胰腺癌免疫组化检测发现TF表达阳性。MRG004A上市后将大大提升后线胰腺癌创新疗法的可及性。
2024年国家癌症中心披露数据显示,2022年中国新发胰腺癌患者约11.87万,死亡病例约10.63万,约80%的胰腺癌患者确诊时已进展至III-IV期,约60%还伴有远处器官转移,失去根治手术机会。MRG004A已于8月获CDE突破性疗法认定并进入III期临床。若MRG004A顺利上市,考虑到“癌王”的难治性,其定价有望达20万元/年(用药时间约3-6个月),再考虑到胰腺癌非化疗治疗方案的选择相对有限,MRG004A渗透率有望达到30%,该药销售峰值有望达到20亿元!
02 MRG003联合普特利单抗治疗一线复发/转移性头颈鳞癌
(2025年《CSCO头颈鳞癌指南》)
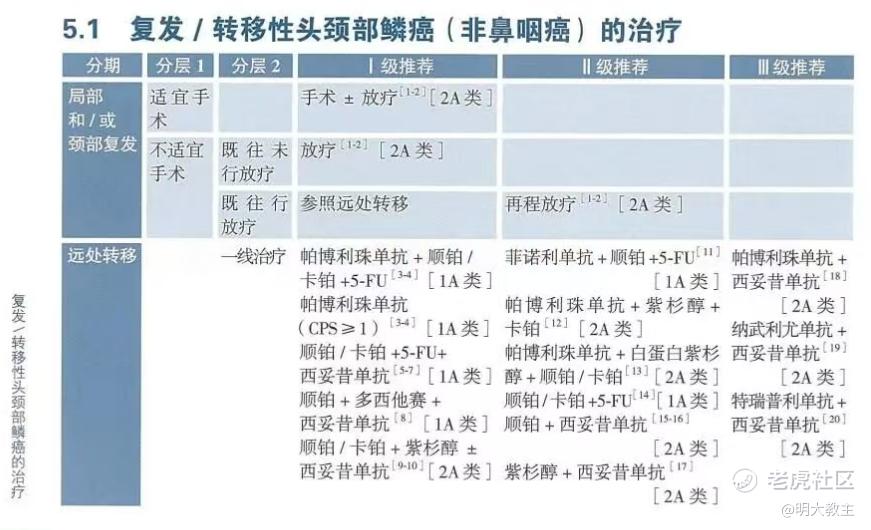
2025年《CSCO头颈鳞癌指南》中,复发/转移性头颈鳞癌一线治疗方案主要为帕博丽珠联合化疗和西妥昔联合化疗。帕博丽珠单抗联合化疗治疗一线头颈鳞癌ORR 36%,mPFS 4.9个月,mOS约13个月;西妥昔单抗联合化疗治疗一线复发/转移性头颈鳞癌ORR 36%,DCR 81%,mPFS 5.3个月,mOS 10.7个月。相较于其他瘤种,还存在有未满足的临床需求。
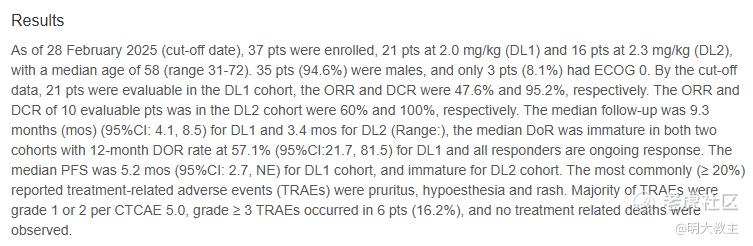
乐普生物在今年ESMO大会上披露,截至2月28日,入组的37例头颈鳞癌患者中,21例接受2.0mg/kg MRG003(EGFR靶向ADC)治疗,16例接受2.3mg/kg MRG003治疗,中位年龄58岁,ECOG评分0分者(体力好的患者)仅有3例,更接近现实世界该病种患者年龄偏大、体力较差的情况。2.0mg/kg 治疗组在随访时间9.3个月时ORR 47.6%,DCR 95.2%,mPFS 5.2个月,所有应答患者均持续应答,12个月mDOR率57.1%(mDOR未成熟);2.3mg/kg治疗组(10例患者可评估),ORR 60%,DCR 100%,mPFS、mDOR未成熟。
安全性方面,最常见的药物相关不良反应是皮疹、瘙痒,大多不良反应为1、2级,严重不良反应发生率低,常见毒性无需特殊干预即可缓解。令人欣喜的是,随着药物剂量的升高,ORR、DCR也越高,且高剂量组安全性表现与低剂量组没有明显差异,将为一线头颈癌治疗提供新的思路。
值得注意的是, $Merus B.V.(MRUS)$ 在今年ASCO上披露Petosemtamab(EGFR x LGR5双抗) 联合K药用于一线治疗 PD-L1 阳性复发/转移性头颈鳞癌II期临床数据ORR 63%,12个月OS率79%,mPFS 9个月的数据后,股价当日便大涨32.68%。据最新消息显示,Genmab已与Merus达成交易协议,前者将以80亿美元的交易对价收购Merus的全部股份。而Merus的核心管线就是已进入III期临床Petosemtamab,该药的适应症正是一线/二线头颈癌。这里可以大胆猜测,若MRG003联合疗法在更长的随访时间中仍能取得接近60%的ORR,mPFS等核心疗效数据也能够保持不错的话,乐普生物该管线商业价值将十分可观。
去年欧洲区一线经治的头颈癌患者约2.6万人,MRG003联合普特利单抗对比单药治疗局部晚期头颈鳞癌的II期临床试验申请已获欧洲药品管理局批准即将临床入组,未来BD的潜力有所增大。
03 MRG003联合普特利单抗治疗复发/转移性鼻咽癌
(2025年CSCO)
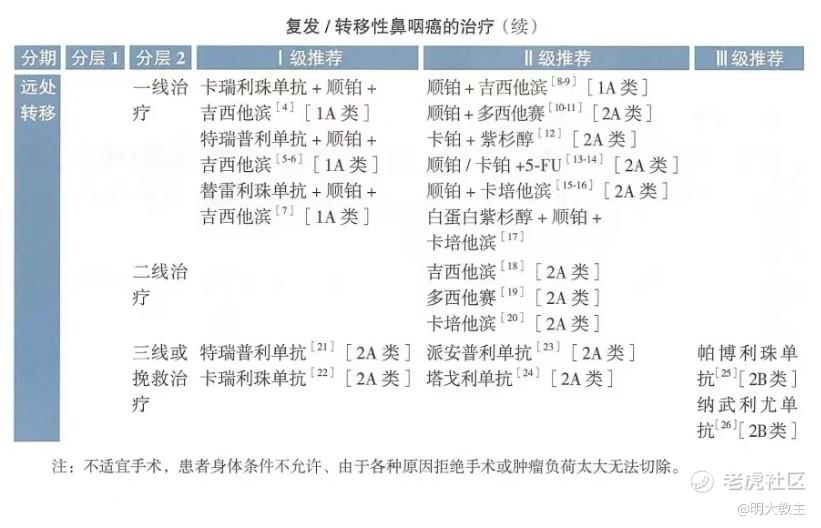
对于后线鼻咽癌患者而言,吉西他滨、多西他赛、卡培他滨单药化疗仍然是CSCO指南的常规推荐。但单药化疗治疗晚期鼻咽癌mPFS不足3个月,仅有10%-20%的ORR!单药化疗对晚期鼻咽癌患者生存质量改善程度有限。
在今年ESMO大会上,乐普生物MRG003联合普特利单抗治疗复发性/转移性鼻咽癌II期临床数据显示:在30名入组患者中,29例接受过PD-(L)1抗体治疗后进展,9例接受过EGFR单抗治疗后进展。截止4月27日,中位随访时间13.1个月时,CR 2例,PR 20例,SD 6例,ORR 为73.3%,DCR为93.3%,mPFS 10.9个月,mDOR 12.1个月,12例患者仍持续受益。经MRG003联合普特利单抗治疗的后线鼻咽癌患者12个月OS率为92.8%,18个月OS率为85.7%,超8成患者存活超18个月。尽管入组患者中96.7%(29/30)此前接受过PD-(L)/1治疗,30%(9/30)接受过EGFR单抗治疗,但MRG003联合普特利单抗方案仍展现出显著疗效,显示联合方案具备“突破耐药”和前所未有历史最佳的治疗潜力。不久前该治疗方案还获得了CDE“突破性疗法”认定。
2022年中国新发头颈鳞癌患者约14.56万人,5年生存率约50%,现存患者中仍有部分为一线局部晚期,MRG003联合普特利单抗头颈鳞癌适应症潜在治疗人数约10万。同期鼻咽癌新增病例5.1万人,由于鼻咽癌5年生存率接近90%,后线患者众多,且我国鼻咽癌患者主要集中于华南的两广、两湖以及福建一带,乐普生物可轻易覆盖绝大部分患者人群。预计MRG003联合普特利单抗鼻咽癌适应症潜在治疗人数约10万。联合疗法获批后年费定价或在18万元/年附近,即使按照偏保守10%渗透率推测,两项联合疗法的市场规模峰值也会超过30亿元。
(乐普生物2025中报)
MRG003已进入NDA最后审核流程,预计今年底/明年初成为国内首个获批的EGFR ADC。MRG003联合普特利单抗治疗头颈鳞癌、鼻咽癌临床也分别推进至II期和III期。
乐普生物的管理团队对管线接续性、管线研究方向的选择、临床策略以及项目自研/BD的研判都相当到位,公司商业化爆发期、Break Even节点将陆续到来。
在MRG003单药获批后,MRG004A、MRG003联合普特利单抗治疗一线复发/转移性头颈鳞癌及复发/转移性鼻咽癌、CG0070、MRG006A、MRG007等管线均值得期待。今年上半年乐普生物营业收入4.65亿元,管线对应市场空间远超百亿,这也将成为乐普生物成长最为确定的支撑力量!
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。