科济药业,有望重塑CAR-T的未来
11月3日,CAR-T细胞疗法领域的龙头企业科济药业公布了两款基于THANK-u Plus®平台开发的通用型CAR-T产品的数据,引发了业内关注。科济药业自主研发的THANK-u Plus®平台是公司在同种异体通用型CAR-T领域的核心创新技术平台。该平台在原有THANK-uCAR®平台的基础上进行了升级,加强对NK细胞活性的调控,不仅有效地解决了通用型CAR-T最大的挑战——宿主抗移植物反应(HvGR),还能克服原THANK-uCAR®平台下NKG2A表达水平对疗效可能的影响。在不同NKG2A表达水平NK细胞的存在下,THANK-u Plus®均可持续扩增,并且扩增率和扩增水平较THANK-uCAR®显著提升。因为在克服HVGR上做足了功课,目前该平台技术并不要求供者和患者的HLA配型,制备和操作便利性大大提高。CT0596和CT1190B正是THANK-u Plus®平台下诞生的两款异体通用型CAR-T产品,CT0596针对BCMA抗原,主要靶标浆细胞,而CT1190B针对CD19和CD20抗原,主要靶标B细胞。
01 同靶点通用型CAR-T中潜在最优的临床疗效数据
1)CT0596治疗多发性骨髓瘤及浆细胞白血病疗效突出
根据2025 ASH会议最新数据,截至2025年6月24日,CT0596 IIT临床研究已入组并治疗8例多发性骨髓瘤患者,既往治疗线数中位数为4.5(范围3-9)。8例患者均纳入疗效评估,中位随访时间为2.56个月,所有患者均未出现疾病进展,5例患者达到部分缓解(PR)或以上疗效,其中3例达到完全缓解/严格意义的完全缓解(CR/sCR),1例达到PR,1例达到非常好的部分缓解(VGPR)。在6例接受30mg/m²的氟达拉滨+500mg/m²的环磷酰胺足量清淋的患者中,3例达到完全缓解/严格意义的完全缓解(CR/sCR),CR率达到50%,1例达到PR,1例达到非常好的部分缓解(VGPR)。8例患者均观察到CAR-T细胞扩增。值得注意的是,CT0596目前仍处于剂量爬坡阶段,4.5×10⁸剂量组2例患者,1例达到CR,1例缓解持续加深中。在目前安全性非常良好的情况下,后续进入剂量扩展及更高剂量探索,疗效有望进一步提高。
安全性方面,未观察到剂量限制性毒性、导致治疗中断或死亡的不良事件。4例患者出现1级细胞因子释放综合征(CRS),均在2-10天内恢复,无2级或以上CRS发生。未观察到ICANS副作用。
此外值得注意的是,公司之前报道的CT0596治疗的3例CR及以上患者,仍在维持之中,其中一例的PR患者达到了VGPR,且患者疗效反应在逐渐加深,不断接近CR。
科济药业于2025年10月披露了CT0596治疗R/R pPCL(复发/难治性原发浆细胞白血病)的两例患者的数据。在疾病负荷较重,进展迅速的R/R pPCL中,CT0596展现了强劲的肿瘤快速清除能力,两例pPCL患者在接受CT0596治疗之后,均达到严格意义的完全缓解,除了CAR-T治疗常见的CRS和血液学毒性以外未见其他器官显著毒性,安全性可控。
多发性骨髓瘤和浆细胞白血病的数据初步展现了CT0596在浆细胞肿瘤中的治疗潜力。
与国外其他通用型BCMA CAR-T产品相比,CT0596显示出明显差异化。Allogene的通用型CAR-T产品ALLO-715的CR/sCR率仅为25% (ASH 2021, Allogene Therapeutics),而Poseida的通用型CAR-T产品P-BCMA-ALLO1的CR/sCR率则只有11%(所有剂量组,0.25-6×10⁶ cells/kg)和22%(2×10⁶ cells/kg剂量组) (IMS 2024, Poseida Therapeutics),且这两款产品都需要更强烈的清淋方案(需要联合阿仑单抗)或者更高的清淋剂量(环磷酰胺要达到750mg/m²),可能会影响产品的安全性;Caribou的CB-011取得较为优异的疗效数据,在推荐剂量下ORR达到92%,CR/sCR率达到75%,但是其需要HLA配型,且其响应率与剂量不成比例关系,考虑受到供者和患者HLA配型的影响。
2) CT1190B在淋巴瘤中实现高扩增效率和高缓解率
除了CT0596公布的浆细胞肿瘤数据,我们更欣喜地看到CT1190B对于THANK-u Plus®平台的再度验证。截至2025年10月17日,本次报道的CT1190B临床试验(NCT07053670, NCT06734871)共纳入14例患者,含3例滤泡淋巴瘤(FL)、3例套细胞淋巴瘤(MCL)以及8例弥漫性大B细胞淋巴瘤(DLBCL)。已经完成了剂量爬坡研究,初步确定了推荐的清淋剂量及细胞剂量。
在氟达拉滨30mg/m²×3+环磷酰胺500mg/m²×3的清淋剂量下,三例FL均达到CR。
在氟达拉滨30mg/m²×3+环磷酰胺1000mg/m²×2的清淋剂量(推荐清淋剂量)下,入组了8例患者,含2例MCL(细胞剂量6×10⁸),6例DLBCL(细胞剂量3×10⁸:1例;4.5×10⁸:1例;6×10⁸:4例)。具体的如下:
● 6例患者达到了疗效评估时间,ORR 83.3%,4例达到CR(2例MCL,2例DLBCL),CRR 66.6%,1例达到PR(DLBCL)。
● 在6×10⁸细胞剂量下,共入组6例患者,4例患者达到疗效评估时间,其中3例达到完全缓解。另有2例DLBCL患者未达疗效评估时间。
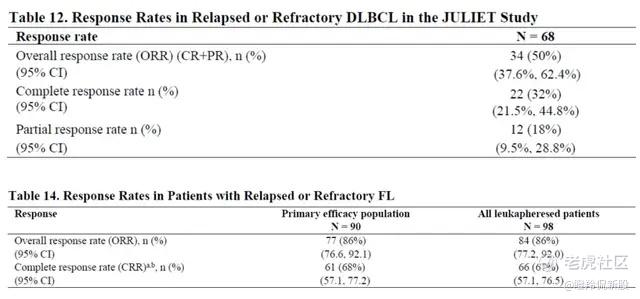
自体CD19 CAR-T Kymriah治疗DLBCL、FL的ORR分别为50%、86%,CRR分别为32%、67%,相比之下,可以看到CT1190B初步临床数据已经表现出可媲美自体CAR-T的ORR和CRR。
在ALPHA2/ALPHA 研究中,ALLO-501通用型CAR-T细胞产品在氟达拉滨+环磷酰胺+ ALLO647(CD52单抗)强清淋方案下,全部受试者的ORR为58%,CRR为42%。
02 同类CAR-T产品中最强的扩增水平
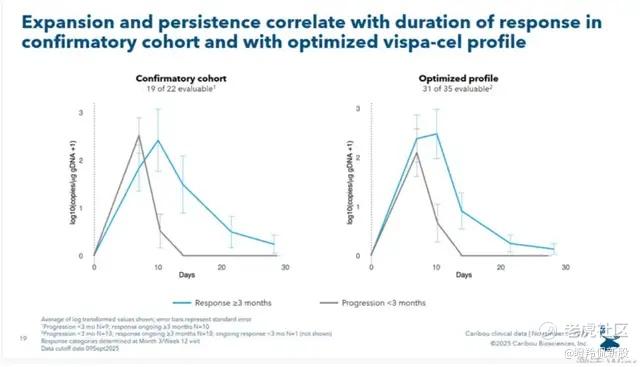
CAR-T细胞在体内的扩增水平是决定疗效持久性的关键因素。科济的通用型CAR-T产品在细胞扩增上表现出色,显著高于目前通用型CAR-T报道的数据,甚至可媲美自体CAR-T产品。
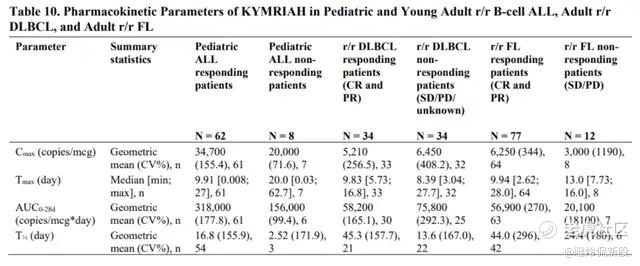
根据本次科济披露的CT1190B数据,6例接受6×10⁸剂量的患者的中位Cmax超过10⁵ copies/ug gDNA,显示出强劲的体内扩增能力。
与海外同类靶点通用型CAR-T产品相比,CT1190B的扩增数据展示出显著优势。与Allogene CD19通用型CAR-T疗法ALLO-501治疗大B细胞淋巴瘤的一期临床数据相比,ALLO-501在有缓解人群的中位CAR-T细胞峰值仅为1688 copies/ug gDNA,而CT1190B高出2个数量级,这也提示CT1190B的缓解深度可能更好。
与自体CAR-T比较,CT1190B的扩增数据亦可媲美。Kymriah在淋巴瘤适应症中的Cmax均值为10³至10⁴ copies/ug gDNA,CT1190B展示出更高的扩增水平。
和最近公布淋巴瘤疗效数据的CARIBOU相比,CT1190B的扩增水平也绝对领先。
03 总结与展望:通用型CAR-T重塑治疗格局
自去年底以来,体内CAR-T热度持续不下,连续几项并购交易诞生,吸引了整个行业对这个方向的关注。今年7月,EsoBiotec公布了体内BCMA CAR-T治疗MM的数据,表现出初步的疗效信号。CAR-T也进入自体、通用、体内三条技术路线同台竞争的时代。自体CAR-T发展时间长,技术成熟,但也面临治疗成本高、副作用大的问题。不仅如此,自体CAR-T在疗效上也存在应用场景的限制,其依赖于患者自身T细胞状态,很容易受到T细胞耗竭的影响,这一点上体内CAR-T也存在同样挑战。
以自体BCMA CAR-T Carvykti临床数据为例,CARTITUDE-2队列C中亚组分析表明BCMA/CD3双抗耐药的患者,Carvykti治疗的ORR仅有57.1%,CRR仅有14.3%,VGPR及以上疗效为42.9%,mPFS仅5.3个月。BCMA ADC耐药的患者,Carvykti治疗ORR为61.5%,CRR为30.8%,VGPR及以上疗效为61.5%,mPFS为9.5个月。BCMA ADC和BCMA/CD3双抗耐药亚组疗效差距较大,可见除了BCMA下调和丢失之外,T细胞耗竭可能对于BCMA CAR-T疗效产生了重要影响。根据科济药业本次公布的CT1190B数据,一例FL患者,CD3/CD20双抗治疗失败,经CT1190B治疗后达到CR;一例FL患者经历了CD19 CART治疗失败,也达到了CR;1例DLBCL患者经历了自体CD19 CAR-T制备失败,经CT1190B治疗后实现PR。说明CT1190B可以一定程度上克服患者T细胞功能缺陷导致的免疫治疗失败。
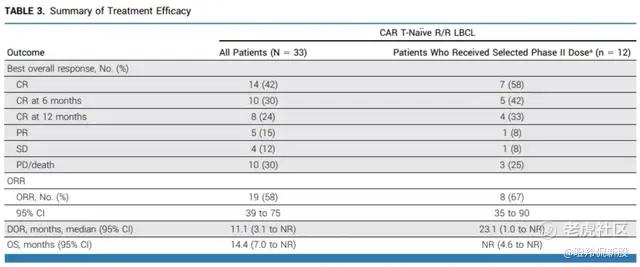
对于慢病毒路线的体内CAR-T,在骨髓瘤已有4例临床数据披露,完全缓解率达到50%,显示出积极的早期疗效。但目前病例数很少(仅4例),观察时间很短(最长观察时间仅3个月),疗效持久性不确定;此外,受限于病毒载体免疫原性问题,估计难以重复给药(比如实体瘤,可能需要重复给药),而通用CAR-T则较容易实现多次给药,根据患者状态巩固或者加深患者的疗效,临床应用灵活性更大。此外,病毒载体也可能引发非靶向感染的安全性问题。成本方面,病毒载体为基础的In vivo CAR-T还可能面临和其它病毒载体为基础的体内基因治疗同样的成本高昂的问题,这些都有待进一步的研究。对于LNP-mRNA技术路线的体内CAR-T,难以将遗传物质遗传到子代,且扩增时间较短,其持久性和清除深度的挑战更大,目前更多用于自身免疫疾病的应用尝试。另外,和自体CAR-T一样,体内CAR-T依赖患者自身的T细胞,一旦出现T细胞耗竭等,疗效也会受到影响。体内CAR-T的一个重要优点是不用清淋,但是不用清淋也可能导致针对CAR的抗药抗体(ADA)产生更明显,进而影响疗效的持久性。
从这次科济公布的两款通用型产品的数据来看,临床疗效和体内扩增,显著优于海外通用型CAR-T,可媲美自体CAR-T。CT0596仍处于剂量爬坡阶段,安全性良好意味着仍可进一步探索高剂量,疗效有望进一步深化。CT1190B公开的药代动力学数据,表明THANK-u Plus®技术平台体内扩增水平与自体CAR-T相当,同时也转化为与其相当的疗效水平,同时保持了优异的安全性。
期待THANK-u Plus®引领通用型CAR-T带来真正的临床突破,并迭代自体CAR-T,提高临床可及性,惠及更多患者。更重要的是,在保持良好安全性的情况下,THANK-u Plus®有望扩展至实体瘤、自免疾病领域,引领通用型CAR-T覆盖更多新的应用场景。 $科济药业-B(02171)$ $传奇生物(LEGN)$ $施贵宝(BMY)$
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。